Einfach mal Pause machen – sich erholen. Das machen wir Menschen gern. Man könnte sogar geneigt sein zu sagen, dass es in unserer Natur liegt. Schaut man etwas genauer auf die Basis unserer Existenz, die Zellen, dann ist dieser Gedanke eigentlich schon ziemlich nah an der molekularen Realität dran. Auch die Zellen machen unter gewissen Umständen eine Pause bzw. hören auf sich zu teilen. Man bezeichnet diesen Zustand als zelluläre Seneszenz.
Umgangssprachlich werden diese Zellen gerne als „Untote“ oder „Zombiezellen“ bezeichnet. Und damit liegen sie ziemlich nah an der Wahrheit, denn seneszente Zellen sind weder tot noch wirklich lebendig. Wir beschäftigen uns in zwei Artikeln mit dieser doch recht neuen Entdeckung der Wissenschaft. Im Artikel über Senolytika zeigen wir dir die wissenschaftlichen Hintergründe und geben dir Tipps aus der Wissenschaft, wie sich man seneszente Zellen wieder loswird. In diesem Artikel geht es mehr um die Seneszenz und ihre Rolle als eines der molekularen Hallmarks of Aging.
Hayflick-Limit und Telomere – wie entstehen die „Untoten“?
Seneszenz (von lat. senescere; altern) spielt als Endstrecke von einigen Prozessen im Körper eine bedeutende Rolle. In den vorherigen Artikeln zur genomischen Instabilität und zur mitochondrialen Dysfunktion haben wir die Seneszenz bereits kennen gelernt. In jungen Jahren scheint die Seneszenz eine Art sicherer Zwischenzustand für entartete Zellen zu sein.
Zelluläre Seneszenz ist nämlich grundsätzlich ein stabiler Stillstand des Zellzyklus. Erste Entdeckungen in diese Richtung machten in den frühen 1960er Jahren die Wissenschaftler Leonard Hayflick und Paul Moorhead. Sie fanden heraus, dass sich menschliche Fibroblasten (Zellen des Bindegewebes) in einer Kultur maximal etwa 50mal teilen, bevor sie plötzlich stillstehen und altern.
Was heute gängig ist, war damals bahnbrechend. In jenen längst vergangenen Tagen herrschte nämlich in der Zellbiologie die Ansicht vor, dass alle gezüchteten Zellen unsterblich sind. Hayflick stürzte dieses Dogma mit seinen Experimenten und fand heraus, dass nur Krebszellen dieses Merkmal haben. Das Phänomen der Teilungsobergrenze heißt replikative Seneszenz, oder nach seinem Entdecker: Hayflick-Limit.
Gegenwärtig wissen wir, dass die von Hayflick beobachtete Seneszenz durch Telomerverkürzung verursacht wird. Es gibt aber auch noch andere Stimuli, abseits des Telomerabriebs, die zelluläre Seneszenz auslösen können.
Wie misst man Seneszenz?
Neben Schäden im Bereich der Telomere tragen insbesondere zwei weitere Punkte zur zellulären Seneszenz bei: nicht-telomerische DNA-Schäden und der INK4/ARF Locus auf der DNA. Beide treten im Zusammenhang mit chronologischer Alterung auf und vermögen es Seneszenz zu induzieren – das hat man in Experimenten nachgewiesen. Aber wie weist man sowas eigentlich nach?
Erstmal wichtig ist die Tatsache, dass Seneszenz nicht direkt messbar ist. Es existiert kein Laborparameter, der nach einer Blutabnahme einen konkreten Wert ausspuckt. Deshalb bedienen sich Forscher sogenannten Ersatzmarkern, die indirekt einen Rückschluss erlauben. Im Fall der zellulären Seneszenz verwendet man als Marker DNA-Schäden oder die Senezenz-assoziierte β-Galaktosidase (SABG).
In einer Studie aus dem Jahr 2009 wurde anhand dieser beiden Parameter eine Quantifizierung bei Mäusen durchgeführt. Dabei ergaben sich Werte von etwa 8% seneszierenden Zellen bei jungen Mäusen und ca. 17% bei sehr alten Mäusen. Betrachtet man die Werte nach Organen so fanden sich ähnliche Werte in Haut, Lunge und Milz. Keine Veränderungen beobachteten die ForscherInnen bei Herz, Niere oder dem Muskelgewebe.
Das ist spannend, weil es bedeutet, dass sich das Ausmaß der zellulären Seneszenz von Gewebe zu Gewebe unterscheidet. Bei Tumorzellen beispielsweise gibt es experimentelle Hinweise, dass sie streng immunüberwacht werden und in der Folge auch effizient entfernt werden können.
Altern und zelluläre Seneszenz
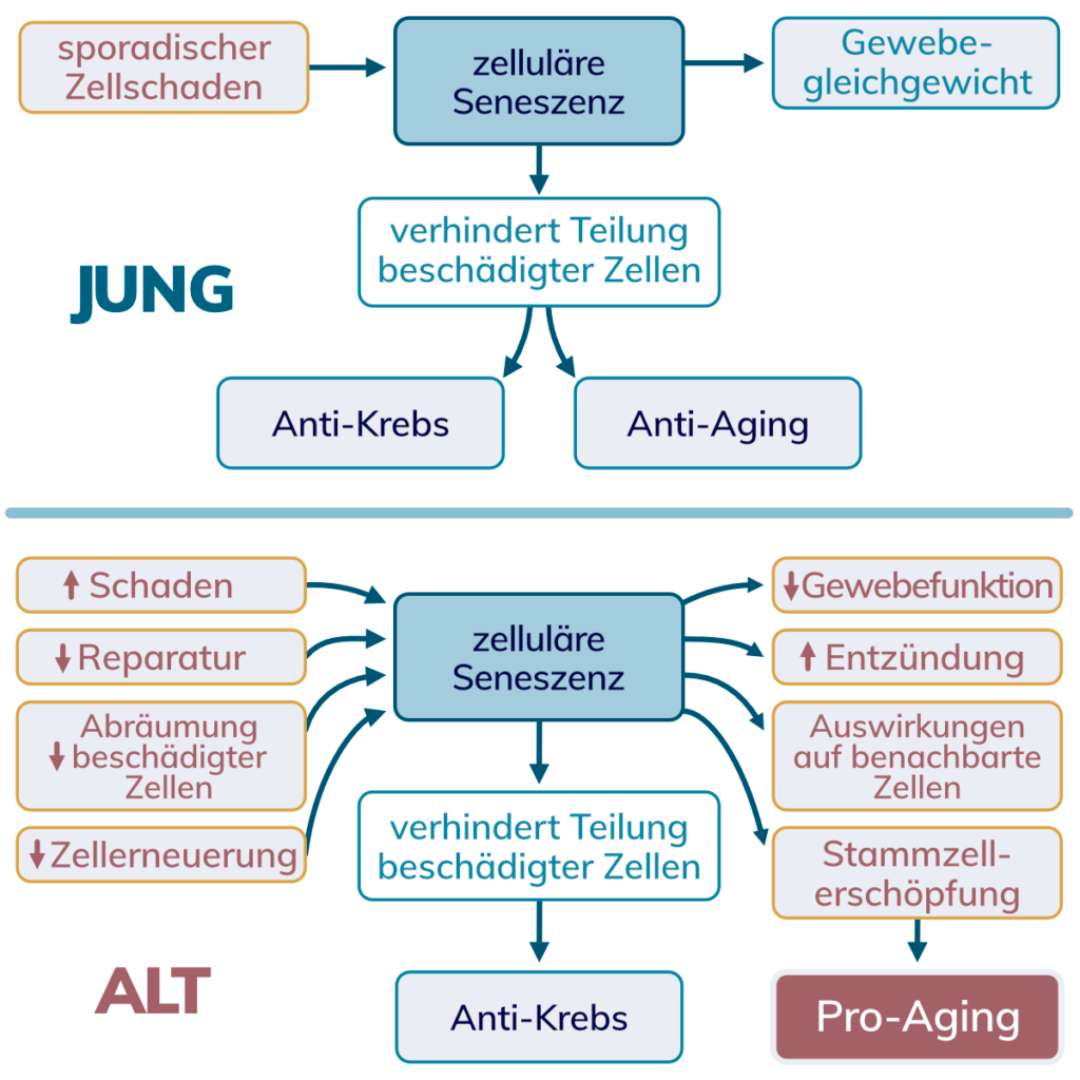
Wir wissen nun, dass mit zunehmendem Alter die Menge an seneszenten Zellen zunimmt. Diese Beobachtung wurde in zahlreichen Studien gemacht. Warum ist das so? Ohne sonderlich detailreich zu werden gibt es darauf eine einfache Antwort. Es werden zu viele dieser „untoten“ Zellen erzeugt oder es werden zu wenige abgebaut. Die Wahrheit liegt irgendwo in der Mitte. Dass deshalb die Alternsforschung nun ein neues Feindbild hat, wäre allerdings zu kurz gedacht. Der Zusammenhang ist nicht so linear, wie es auf den ersten Blick scheint.
Möglicherweise ist der Hauptzweck der Seneszenz ein ganz anderer. Nämlich die Verhinderung der Vermehrung von geschädigten Zellen und das Auslösen der Abräumung durch das Immunsystem. Wir erinnern uns, dass DNA-Schädigung ein Ersatzmarker ist, mit dem Seneszenz quantifiziert wird. Seneszenz ist u.A. eine vorteilhafte Ausgleichsreaktion, um Gewebe von kaputten und eventuell sogar tumorösen Zellen zu befreien.
Die Voraussetzung dafür ist allerdings ein wirkungsvolles Zellersatzsystem. Denn die seneszenten Zellen müssen erst entfernt und in weiterer Folge auch wieder ersetzt werden, damit die Homöostase bzw. das Gleichgewicht im Gewebe erhalten bleibt. Genau hier ist der Haken bezugnehmend auf das Altern.
Dieses Umsatzsystem hat mit zunehmendem Alter eine Tendenz zur Ineffizienz, was sich in einer mangelnden Regenerationskapazität von Zellen widerspiegelt. Damit kommt es zur Ansammlung von seneszenten Zellen, die über kurz oder lang den Schaden verschlimmern und das Altern verstärken. Allein die Anwesenheit von einer stetig zunehmenden Anzahl an stillgelegten Zellen ist jedoch nicht entscheidend dafür. Vielmehr ist das Sekretom der Übeltäter.
Sekretom klingt erstmal geheimnisvoll, ist aber „nur“ die Gesamtheit aller sezernierten Stoffe einer Zelle. Im Fall von seneszenten Zellen ist das Sekretom besonders reich an entzündungsfördernden und destruierenden Stoffen. Genannt wird es in der Wissenschaft Senescence-Associated Secretory Phenotype (SASP). Warum genau diese Entzündungsstoffe Probleme machen können, erfährst du in unserem Artikel zum Inflammaging.
Mitogene Signalübertragung – wenn bei der Zellteilung etwas schief geht
Neben DNA-Schäden ist eine überschießende mitogene (Zellteilung induzierende) Signalübertragung mit Seneszenz verbunden. Mitogen kann man sich als MITOse GENerierend leichter merken. Mitose ist der Vorgang der Zellteilung. Es gibt eine ganze Menge dieser mitogenen oder auch onkogenen (krebs-erzeugenden) Veränderungen. Als Reaktion auf diese Signale kann in der Zelle Seneszenz ausgelöst werden. Auch hierfür gibt es reihenweise Mechanismen, der INK4a / ARF-Locus ist aber in der Bedeutsamkeit unübertroffen.
INK4a / ARF-Locus und p53 – was versteckt sich hinter den Abkürzungen?
Nicht erschrecken, das Thema ist nicht annähernd so kompliziert, wie die Überschrift vermuten lässt. Das Ausmaß von p16INK4a (das Protein, welches auf Basis des INK4a Gens erzeugt wird) hängt mit dem chronologischen Alter in allen analysierten Geweben, sowohl bei Mäusen als auch beim Menschen zusammen. Diese kolossale Relevanz ist bemerkenswert. Der INK4a/ARF-Locus (Ort auf der DNA) wurde in einer Metaanalyse (höchste wissenschaftliche Evidenz) als der genomische Ort identifiziert, der mit der höchsten Anzahl altersassoziierter Pathologien verbunden ist.
Dazu zählen verschiedene Arten von Herz-Kreislauf-Erkrankungen, Diabetes, grüner Star und die Alzheimer-Krankheit. p53 ist ein weiteres Protein, das Seneszenz induziert. „p“ steht im Rahmen der Nomenklatur immer für Protein.
Wusstest du? Das Protein p16Ink4a ist ebenfalls in seneszenten Leberzellen nachweisbar ist. Eine Anhäufung dieser „Zombie“-Zellen im Laufe der Zeit trägt zur Aktivierung entzündungsfördernder Signale aus den Zellen, auch bekannt, als das Senescence-Associated Secretory Phenotype (SASP), bei, was zu einer verstärkten Entzündung und einer erhöhten Ansammlung von Fett in der Leber führen kann. Dieser Prozess ist häufig mit der nicht-alkoholischen Fettlebererkrankung (NAFLD) assoziiert.

Gegensätzlich, aber doch gleich?
Aufgrund der Seneszenz-induzierenden Funktion von p16INK4a und p53 stellten ForscherInnen die naheliegende Hypothese auf, dass die beiden Proteine zur physiologischen Alterung beitragen. Die altersfördernde Wirkung ist demnach zu vernachlässigen, wenn man die viel wichtigeren Vorteile bei der Tumorsuppression betrachtet. Tatsächlich ist die Thematik aber etwas komplizierter, was gegenläufige Forschungsergebnisse vermuten lassen.
Bei aufgrund von ausgedehnten und anhaltenden Zellschäden vorzeitig gealterten Mäusen erreichte eine Eliminierung von p16INK4a und p53 eine Verbesserung der Gesamtfunktion des Organismus. In einem weiteren Experiment wiesen Mäuse mit einem leichten Anstieg der beiden Proteine eine längere Lebensdauer auf. Dieser Überlebensvorteil war größer, als ein geringeres Krebsauftreten vermuten lassen würde.
Die Aktivierung der beiden genannten Proteine ist somit im Hinblick auf die Entwicklung von Tumoren und damit Krebs eine vorteilhafte Reaktion. Dadurch wird die Ausbreitung von mutierten Zellen verhindert. Wenn Schäden aber um sich greifend sind und einen großen Anteil der Zellen unseres Körpers betreffen, dann kann der Körper nicht mehr mithalten: die Regenerationsfähigkeit erschöpft. Unter diesen Bedingungen ist die Aktivierung von INK4a / ARF nachteilig und Altern wird beschleunigt.
Zelluläre Seneszenz – Fazit
Zelluläre Seneszenz ist eine nützliche kompensatorische Reaktion auf Schäden, die aber auch das Altern beschleunigen und der Gesundheit abträglich sein kann, wenn sich Gewebe nicht mehr ausreichend erholen können. Letzten Endes existieren abgeleitet von Studien zwei konträre Interventionsansätze, die bis dato beide einen Beitrag zur Langlebigkeit leisten können.
Zum einen hat eine Tumorsuppressorwirkung positive Effekte auf das Altern. Auf der anderen Seite zeigt die Eliminierung von seneszenten Zellen in Experimenten eine Verzögerung von altersbedingten Krankheiten. Die „Untoten“ sind also nicht komplett nutzlos.
Vermutlich ist es wie immer in der Natur. In der richtigen Balance sind seneszente Zellen für unsere Gesundheit förderlich, da sie uns z.B. darin unterstützen kaputte Zellen einzufrieren, damit sie nicht noch weiter entarten. Auf der anderen Seite kann die Anzahl an seneszenten Zellen im Alter so stark zunehmen und damit auch die Entzündungen, dass alterstypische Erkrankungen gefördert werden.
Im nächsten Artikel dieser Reihe geht es um das achte Kennzeichen des Alterns: Stammzellerschöpfung.
Literatur
- López-Otín, Carlos et al. “Hallmarks of aging: An expanding universe.” Cell vol. 186,2 (2023): 243-278. Link
- van Deursen, Jan M. “The role of senescent cells in ageing.” Nature vol. 509,7501 (2014): 439-46. doi:10.1038/nature13193 Link
- Baker, Darren J et al. “Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders.” Nature vol. 479,7372 232-6. 2 Nov. 2011, doi:10.1038/nature10600 Link
- Freund, Adam et al. “Inflammatory networks during cellular senescence: causes and consequences.” Trends in molecular medicine vol. 16,5 (2010): 238-46. doi:10.1016/j.molmed.2010.03.003 Link
- Ellison-Hughes, Georgina M. “First evidence that senolytics are effective at decreasing senescent cells in humans.” EBioMedicine vol. 56 (2020): 102473. doi:10.1016/j.ebiom.2019.09.053 Link
Grafiken
Die Bilder wurden unter der Lizenz von Canva erworben.