Die Epigenetik ist eines der spannendsten Forschungsfelder. Dachte man früher, dass alles in den Genen steckt, so weiß man heute, dass nur etwa 20% direkt vererbt wird und die restlichen 80% unserer Lebensspanne durch die epigenetische Veränderungen bestimmt werden.
Der Durchschnittserwachsene besteht aus der immensen Zahl von etwa 100 000 000 000 000 Zellen. Mit nur wenigen Ausnahmen wie beispielsweise reifen roten Blutkörperchen, besitzen alle diese Zellen einen Zellkern, in dem sich das menschliche Genom befindet. Diesen Begriff kennen wir bereits vom ersten Hallmark of Aging – der genomischen Instabilität. Demnach ist das Genom ein Begriff, der vereinfacht die Gesamtheit der vererbbaren Informationen eines Individuums bezeichnet. Das sind Informationen für die Herstellung von Proteinen, die das Erscheinungsbild des Körpers mitbestimmen und verändern.
Und was macht nun die Epigenetik? Vereinfacht gesagt bestimmt die Epigenetik, welche Information abgelesen wird und welche nicht. Wir zeigen dir hier, welche Auswirkungen die Epigenetik haben kann und was epigenetische Veränderungen mit dem Alter zu tun haben.

Was macht die Epigenetik?
In jeder Zelle befindet sich ein- und dieselbe Erbinformation. Wie kann es dann sein, dass manche Zellen zu Muskelzellen werden und andere wiederum zu Hautzellen? Die Antwort liegt im Zellkern versteckt.
Wir Menschen besitzen nämlich nicht nur ein Genom, sondern auch ein Epigenom. Das Epigenom ist eine Sammlung chemischer Veränderungen an der DNA, die praktisch wie ein Schalter funktioniert. Viele Gene besitzen einen solchen Schalter. Ist der Schalter ON, dann wird das Gen „exprimiert“, sprich: der Bauplan wird in die Tat umgesetzt und damit das gewünschte Protein hergestellt. Ist das Gen abgeschaltet (OFF), wird es als stumm angesehen und kein Protein erzeugt.
Vielleicht zur besseren Veranschaulichung. Stell dir vor, deine DNA ist der Text in einem Buch. Du liest aber nie das gesamte Buch, da es viel zu groß ist, sondern immer nur Abschnitte daraus. Damit du dir merken kannst, welche Abschnitte du lesen willst, hast du kleine Post-It Zettel an den Anfang und das Ende der Textpassage geklebt. Diese Post-it Zettel sind deine epigenetischen Marker.
Chemisch ausgedrückt sind es methylierte Stellen auf deiner DNA. Sie ändern dabei nicht deine DNA an sich, sondern bestimmen welche Abschnitte gelesen werden – und welche eben nicht. Um das Ganze noch komplizierter zu machen: Die Textabschnitte ändern sich in deinem Leben. Mal werden Passagen aus dem einen Kapitel gelesen und mal Passagen aus dem anderen Kapitel. Und es kommt auch darauf an, welche Zelle du betrachtest.
Wusstest Du? Die Epigenetik wird benutzt, um das biologische Alter zu messen. Anhand der Oberflächenmerkmale der DNA und moderner Algorithmen kann mittlerweile ziemlich genau berechnet werden, wie alt eine Körperzelle im Vergleich zum chronologischen Alter ist. Genau diese Technik kommt auch beim epiAge-Test zum Einsatz.
Fast noch spannender ist die recht neue Methode die Proteine in den Zellen zu messen. Mit Hilfe der sogenannten Proteomik geht man einen Schritt weiter und misst nicht die DNA, sondern die produzierten Proteine. Dies erlaubt einen moderneren und genaueren Blick auf den Zellmetabolismus.
Die Vielfalt der Gene
Jedes Gen beinhaltet den Bauplan für eines oder mehrere Proteine. Ermöglicht wird dies durch einen Prozess namens „alternatives Spleißen“. Das bedeutet, dass nicht immer die gesamte Information auf einem Gen abgelesen bzw. verwendet wird, sondern für manche Proteine nur Teile davon.
Dementsprechend übersteigt die Anzahl der Proteine die Anzahl der Gene deutlich: Geht die Wissenschaft heute von 20.000 bis 25.000 menschlichen Genen aus, so wird die Anzahl der Proteine beim Menschen auf 80.000 bis 400.000 geschätzt. Genauere Aussagen sind derzeit schwer möglich, weil die Forschung von der Entschlüsselung aller Proteine noch weit entfernt ist.
Helfen wird hier sicherlich eine bahnbrechende Entwicklung des Unternehmens DeepMind, die mit Hilfe eines neuronalen Netzwerkes namens AlphaFold eine Software entwickelt haben, die die 3D-Struktur von Proteinen voraussagen kann.
Die Rolle der epigenetischen Fixierung
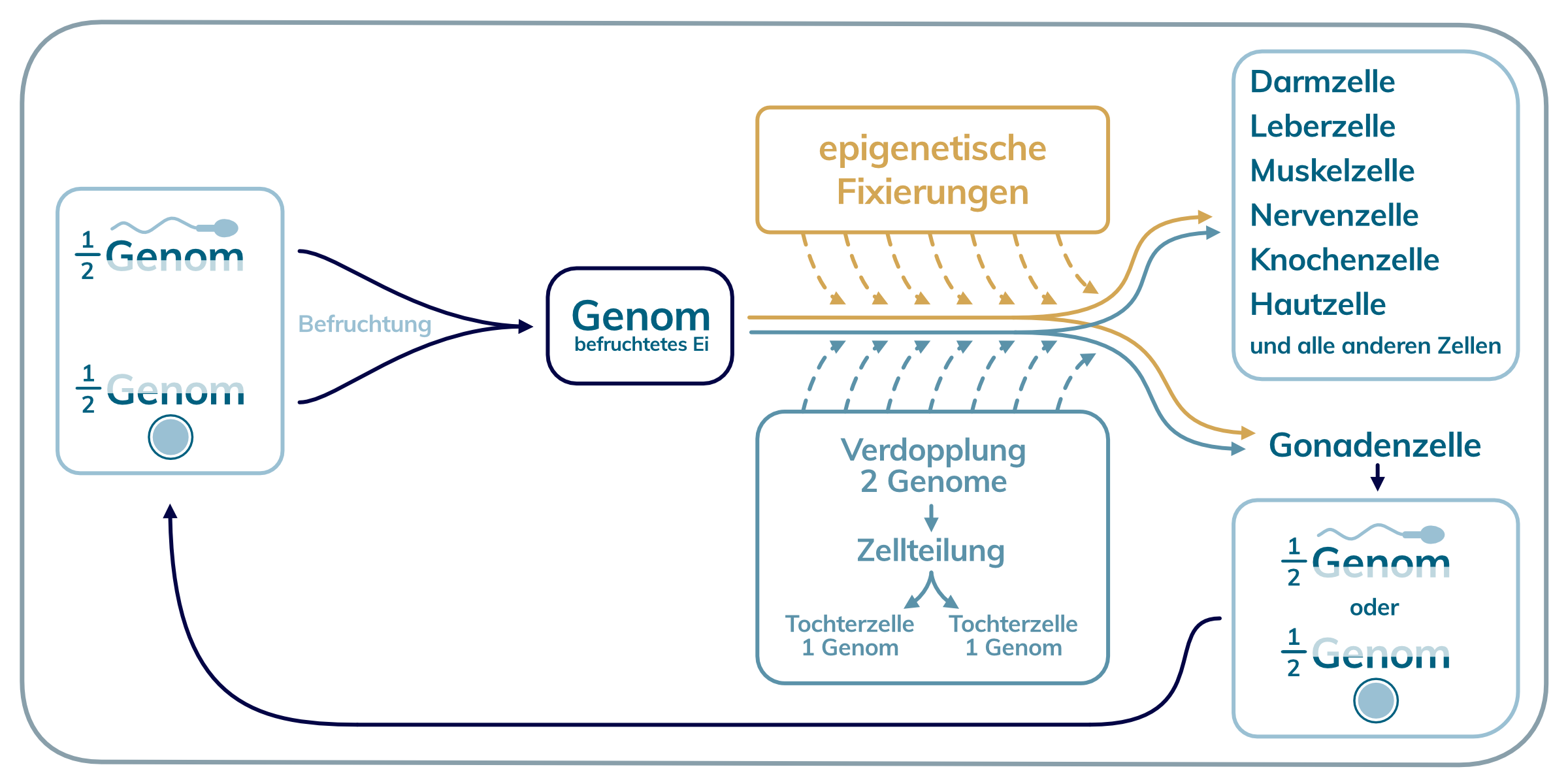
Die Rolle der epigenetischen Fixierung
Die Epigenetik, auch epigenetische Fixierung oder epigenetische Prägung bezeichnet, ist der Grund, warum sich aus Zellen mit gleichen Voraussetzungen unterschiedliche Zelltypen entwickeln. Sie haben alle dasselbe Genom, aber verschiedene Epigenome, die ihnen sagen, welche Proteine produziert werden müssen und welche Art von Zellen sie letzten Endes sein müssen.
Zusätzlich dazu ist Epigenetik, zumindest laut dem aktuellen Forschungsstand, teilweise vererblich. Noch ist die Forschung zur Epigenetik ein recht junges Feld, es gibt aber schon einige spannende Ergebnisse.
Wusstest Du? Nachdem wir herausgefunden haben, dass wir mit Hilfe der epigenetischer Veränderungen das biologische Alter herausfinden können, stellt sich noch die Frage, wie wir dieses beeinflussen können. Neben Sport und Fasten gibt es auch einige Moleküle, die uns bei der Senkung des biologischen Alters helfen können. Ganz vorne mit dabei ist Calcium-Alphaketoglutarat (Ca-AKG). In menschlichen Studien konnte es das biologische Alter um bis zu 7 Jahre senken! Zusätzlich hilft es noch beim Muskel- und Knochenaufbau und unterstützt unsere Mitochondrien.
Ist die Epigenetik teilweise verantwortlich für die Epidemie an Übergewicht?
Nach Zahlen der WHO hat sich seit 1975 die Rate an Menschen mit Übergewicht verdreifacht. Weltweit sollen demnach 1,9 Milliarden Menschen im Jahr 2016 übergewichtig gewesen sein.
Übergewicht, gerade schweres Übergewicht mit hohem viszeralen Fettanteil stellt ein Risiko für viele altersbedingte Erkrankungen, wie Diabetes mellitus und kardiovaskuläre Erkrankungen, dar.
Doch woher kommt dieser starke Anstieg an Übergewicht? Ein Großteil wird durch falsche Essgewohnheiten und zu wenig Bewegung bedingt, aber hier hat auch die Epigenetik ihre Finger im Spiel.
Mehrere Tierexperimente lassen den Schluss zu, dass Kinder von übergewichtigen Elternteilen epigenetische Muster übertragen bekommen, die eine Veranlagung bedingen schneller mehr Gewicht anzusetzen. Der wichtige Punkt in den Experimenten war: Es ist oftmals nicht die vererbte Genetik, sondern das vererbte epigenetische Muster.
Die gute Nachricht hier ist jedoch, dass dieses Muster durchbrochen werden kann, indem man z.B. durch die richtige Ernährung die schädlichen epigenetischen Marker durch neue, vorteilhaftere ersetzt. Wie genau so etwas auch bei Menschen aussehen kann, muss aber noch weiter erforscht werden.
Epigenetische Veränderungen und Altern
Das Epigenom verändert sich, im Gegensatz zur starren DNA-Matrize des Genoms, zeitlebens. Veränderungen treten beispielsweise während der physiologischen Entwicklung auf, aber auch Umweltfaktoren wie Stress, Krankheit oder Ernährung wirken sich aus und nicht alle Veränderungen sind zum Besten.
Unterschiedliche Einrichtungen der Epigenetik verursachen die Veränderungen. Diese Komplexität ist auch der Grund, weshalb wir unsere Aufmerksamkeit exemplarisch nur einem, dafür aber sehr wichtigen epigenetischen Mechanismus zuwenden: der DNA-Methylierung.
Dieses Fremdwort bezeichnet die Übertragung von speziellen chemischen Molekülen, den Methylgruppen, auf die DNA. Die restlichen chemischen Spitzfindigkeiten lassen wir, aus Gründen der Verständlichkeit, weg. Als Folge des Anbringens von diesen chemischen Gruppen, verändert sich die Architektur der DNA. Wohingegen beim Hausbau dann die Stabilität leidet, ist bei der DNA das Ablesen von Proteinen nur mehr verändert möglich. Um nochmals auf unsere Analogie von am Anfang zurückzugreifen. Die DNA-Methylierungen sind die farbigen Post-it Zettel, die dir sagen, ob du den Text dahinter lesen willst oder nicht.
Chemische Reaktionen im Körper, und damit auch die Übertragung von Methylgruppen, benötigen in der Regel die Anwesenheit von Enzymen, da diese die optimalen Voraussetzungen schaffen. Entsprechend sind auch hier Enzyme nötig, die sogenannten DNA-Methyltransferasen (Enzyme, die die Methylgruppen auf die DNA übertragen). Was hat dieser doch recht komplizierte Input jetzt mit der Alterung zu tun?
Neuere Untersuchungen haben gezeigt, dass mit fortlaufender Zeit immer mehr Methylgruppen an die DNA binden. Epigenetische Veränderungen nehmen mit dem Alter also in Summe zu – ein Umstand, den sich die Horvath-Clock zunutze macht.
Progerie und DNA-Methylierung
Nochmal zur Erinnerung: Progerie ist eine Gruppe von Erkrankungen mit eklatant (bis zu 10-fach) erhöhter Alterungsgeschwindigkeit. So ist es zum Beispiel möglich, dass ein zehnjähriges Mädchen mit Progerie ein biologisches Alter von 70 Jahren aufweist. Mehr Details zu Progerien findest du beim ersten Hallmark of Aging, der genomischen Instabilität.
Bei diesen Personen und ebenfalls betroffenen Mäusen fanden ForscherInnen in großen Teilen ähnliche Methylierungsmuster, wie bei gesunden Personen in hohem Lebensalter. Ein Zusammenhang zwischen DNA-Methylierung und dem Alter ist also bereits präsent. Offen ist noch ein direkter experimenteller Nachweis dafür, dass die Lebensdauer des Organismus durch Veränderung der DNA-Methylierungsmuster verlängert werden kann.
DNA-Methylierung

Epigenetische Veränderungen – Ausblick
Im Gegensatz zu DNA-Mutationen sind epigenetische Veränderungen reversibel. Auf Basis dieser Tatsache ergeben sich Möglichkeiten für die Entwicklung von neuen Longevity-Behandlungen. Die Gesamtheit der gegenwärtigen wissenschaftlichen Evidenz legt nahe, dass das Verständnis und die Manipulation des Epigenoms vielversprechend für die Verbesserung von altersbedingten Pathologien ist. Damit untrennbar verbunden ist eine Verlängerung der gesunden Lebensdauer.
Betrachtet man die enorme Komplexität der Epigenetik auf der einen Seite und den aktuellen Forschungsstand auf der anderen Seite, dann stellt man allerdings fest, dass die Bemühungen, speziell im Hinblick auf den Menschen, noch in den Kinderschuhen stecken. Die nächsten Jahre und Jahrzehnte zeigen, inwiefern sich daraus handfeste Ansatzpunkte für Anti-Aging und Prävention ableiten lassen. Schließlich ist Forschung keine Einbahnstraße in Richtung Erfolg – bestimmt aber eine in Richtung Verständnis und Aufklärung.
Im nächsten Artikel dieser Reihe geht es um das vierte Kennzeichen des Alterns: Verlust der Proteostase.
Literatur
- López-Otín, Carlos et al. “Hallmarks of aging: An expanding universe.” Cell vol. 186,2 (2023): 243-278. Link
- Kleinert, Maximilian et al. “Animal models of obesity and diabetes mellitus.” Nature reviews. Endocrinology vol. 14,3 (2018): 140-162. Link
- Ouni, Meriem, and Annette Schürmann. “Epigenetic contribution to obesity.” Mammalian genome : official journal of the International Mammalian Genome Society vol. 31,5-6 (2020): 134-145. Link
- Durairaj, Janani et al. “Uncovering new families and folds in the natural protein universe.”Nature 622,7983 (2023): 646-653. Link
Grafiken
Die Bilder wurden unter der Lizenz von Canva erworben.