Alle Zellen nutzen eine Menge unterschiedlicher Qualitätskontrollmechanismen, um die Funktionalität und Stabilität ihrer jeweiligen Proteinvielfalt zu sichern. In der Fachwelt bezeichnet man diesen Vorgang als Proteostase. Proteostase setzt sich aus den beiden Begriffen Proteom (Gesamtheit der Proteine, die eine Zelle produzieren kann) und Homöostase (Gleichgewicht) zusammen. Im Optimalfall sind die Proteine einer einzelnen Zelle also immer korrekt gefaltet und in stets passender Menge vorhanden. Allen noblen Bemühungen zum Trotz schafft es unser Körper nicht dieses Optimum zu gewährleisten. Wir zeigen dir in diesem Artikel, was das Altern und einige altersassoziierte Krankheiten mit einem Verlust der Proteostase zu tun hat.
Von der DNA über die Kette zum Protein
Zunächst müssen wir ein besseres Verständnis für den molekularen Aufbau von Proteinen bekommen. Jedes Protein wird auf ähnliche Art und Weise hergestellt. Der erste Schritt, auch als Transkription bezeichnet, findet im Zellkern statt und meint das Ablesen und Abschreiben des Bauplans von der DNA – unserer Erbsubstanz.
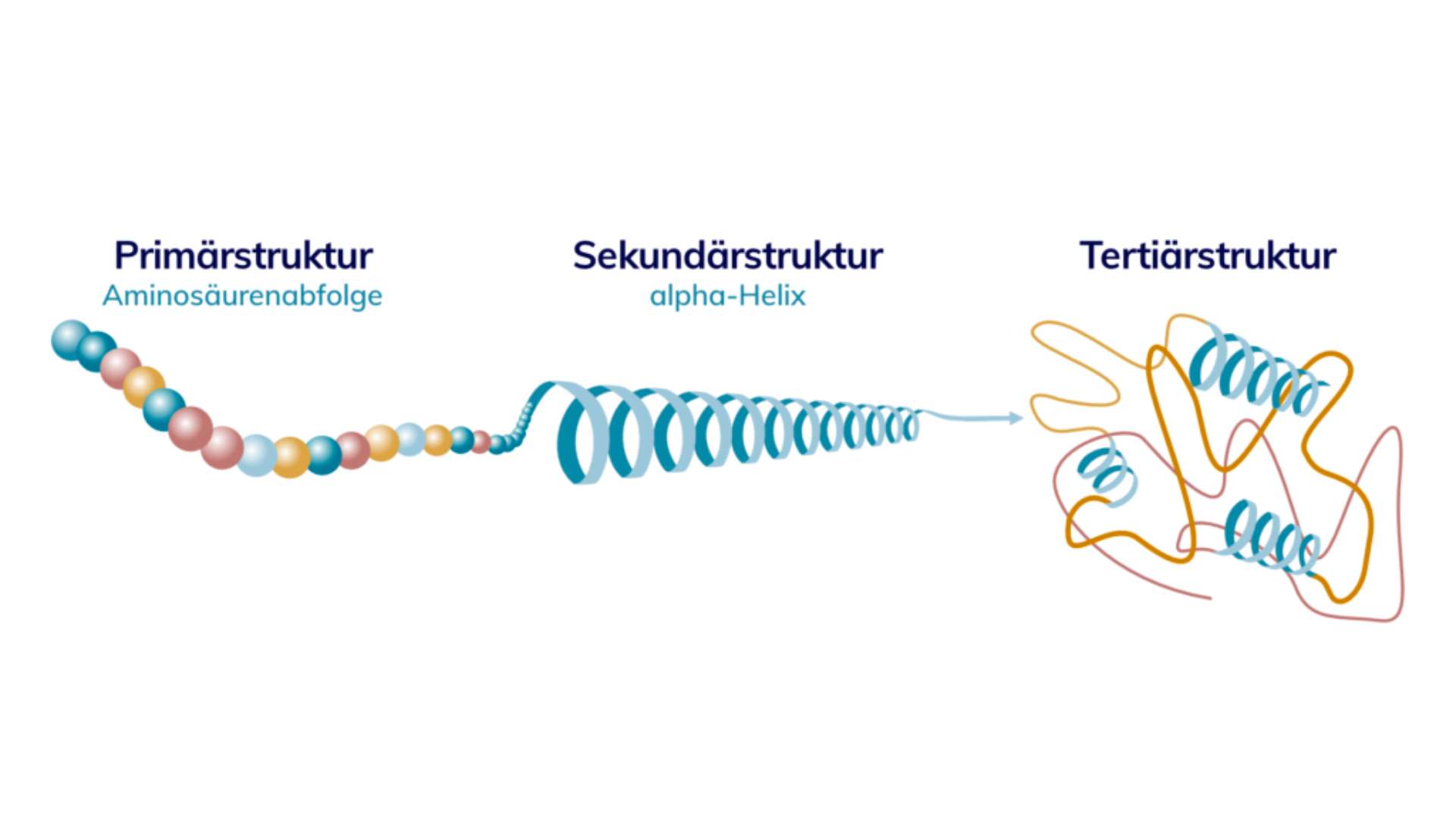
Dann erfolgt ein Transport dieser abgeschriebenen Information aus dem Zellkern heraus, ebenso wie eine Übersetzung (Translation). Das bedeutet, dass DNA-Sprache in Protein-Sprache übersetzt wird, sprich das Protein auf Basis des DNA-Bauplans zusammengesetzt wird. In erster Linie ist ein Protein dann eine lange lineare Kette von Aminosäuren, ähnlich einer Perlenkette. Diese lose Abfolge von Aminosäuren nennt man Primärstruktur.
Damit die Proteine in Primärstruktur nun ihre Arbeit aufnehmen können, müssen sie noch gefaltet werden, wobei es sich um einen sehr komplexen Vorgang handelt. Zuerst kann die Proteinkette beispielsweise verdrillt werden, wodurch eine Spirale entsteht, die wegen der typischen Form alpha-Helixgenannt wird. Diese Form ist die häufigste Sekundärstruktur. Durch weitere Faltungsschritte erreichen die Proteine eine dreidimensionale Form – die Tertiärstruktur. In diesem Zustand verbinden sie sich und arbeiten mit anderen Proteinen zusammen.
Wusstest Du? Die erste Aminosäure, die entdeckt wurde, war 1810 das Cystin. Bis ein ganzes Protein in seiner Aminosäurensequenz (Primärstruktur) entschlüsselt wurde, dauerte es bis 1953. Frederic Sanger konnte die Aminosäurensequenz von Insulin entschlüsseln.
Chaperone – Die Anstandsdamen unseres Körpers
Du siehst an dem Schaubild, dass es mit der Aminosäurensequenz als Primärstruktur nicht getan ist. Damit die Proteine in unserem Körper ihre Aufgaben erledigen können, benötigen sie einige Zwischenschritte. Erst in der Tertiärstruktur bilden die Aminosäuren ein dreidimensionales Gebilde, welches funktionsfähig ist. Bis sie dort hinkommen, ist einiges an Arbeit von Nöten.
Es müssen neue Verbindungen geknüpft werden und schwefelhaltige Brücken werden zwischen einzelnen Aminosäuren gebildet. Das Ganze wird sehr komplex und ist extrem fehleranfällig. Eine falsche Bindung und das Protein ist funktionsunfähig. Deshalb existieren mehre Qualitätskontrollen in unserem Körper, die garantieren sollen, dass alles seine Richtigkeit hat.
Eine dieser Qualitätskontrollen sind die Chaperone. Interessiert sich jemand für England und Sprache, dann ist die Bedeutung durchaus häufig bereits klar. Kleiner Tipp: es wird sehr gerne in der erfolgreichen Netflix Serie „Bridgerton“ benutzt.
Ein Chaperon ist demnach eine ältere Frau, die eine jüngere als Beschützerin begleitet. Eine Anstandsdame aus England ist im Körper dann sowas wie ein Anstandsprotein. Es hilft einerseits neuen Proteinen sich zu falten oder kaputten Proteinen sich wieder richtig zu falten.
Wusstest Du? Wie viele Proteine gibt es auf der Welt? Die Komplexität der Protein-Architektur ist nur schwer greifbar. Aus diesem Grund haben Wissenschaftler eine künstliche Intelligenz entwickelt, die mit hoher Wahrscheinlich die dreidimensionale Form eines Proteins voraussagen kann. „AlphaFold“ konnte allein im Jahr 2022 215 Millionen Proteine und ihre Tertiärstruktur voraussagen. Die Arbeit der Forscher aus Bael gilt als eine der bedeutendsten der letzten Jahre, denn mit Hilfe der künstlichen Intelligenz lassen sich so Arzneimittel und Impfstoffe in der Zukunft schneller entwickeln.
Verlust der Proteostase – wie kommt es zu falsch gefalteten Proteinen?
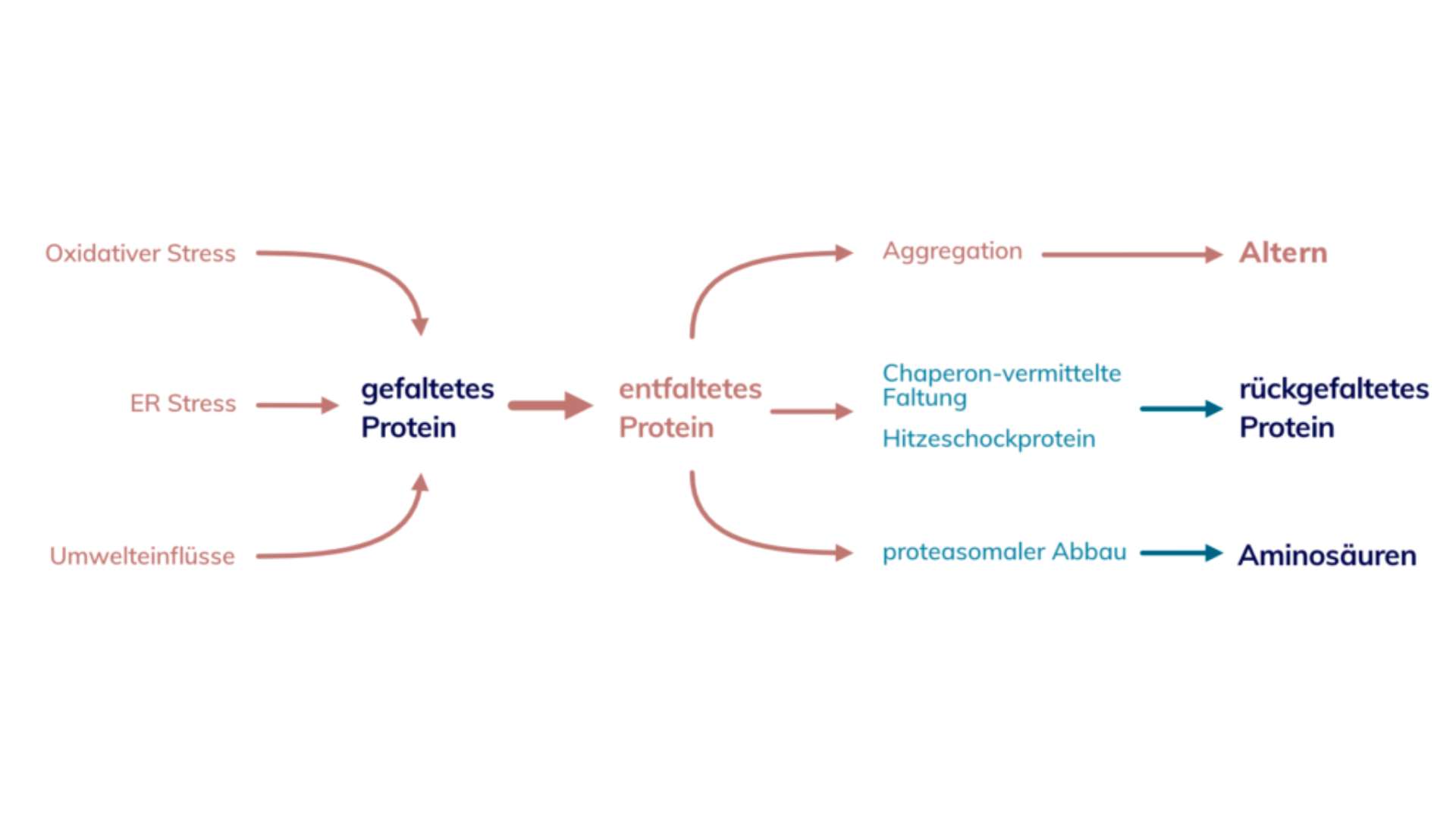
Zwischen 40 und 80% aller Proteine werden falsch gefaltet und benötigen Hilfe. Das ist eine enorme Anzahl. Es gibt einige Faktoren, die sich negativ auf die Proteinstruktur auswirken können. Dazu zählen Ultraviolettstrahlung, Schwermetalle, Hitze oder Ethanol. Gerade bei Lebensmitteln oder Nahrungsergänzungsmitteln ist es deshalb wichtig, auf entsprechende Zertifikate zu achten.
Diese Umwelteinflüsse beeinflussen unsere Proteine gleichermaßen wie unsere DNA. Außerdem setzt oxidativer Stress – umgangssprachlich ein Überschuss an freien Radikalen – dem Proteingleichgewicht zu. Damit nicht genug gibt es noch den ER-Stress.
ER steht für endoplasmatisches Retikulum, eine Einrichtung in jeder unserer Zellen, dessen Funktion man als Logistikzentrum beschreiben könnte. Ebendieses Logistikzentrum kann ob des großen Bedarfs überlastet sein und Ware nicht mehr korrekt geliefert werden. Was bei Amazon, Alibaba und co. für viel Ärger sorgen würde, ist auch für die Zelle gefährlich. Alle genannten Einflüsse können Proteine entfalten und damit nutzlos werden zu lassen.
Proteostase – wie sich der Körper zur Wehr setzt
Die Proteostase umfasst einige Einrichtungen in dem Bestreben das Gleichgewicht zu erhalten. Aus Gründen der Übersichtlichkeit legen wir unsere Aufmerksamkeit auf zwei der bedeutendsten Mechanismen. Als Reaktion auf schädliche Umwelteinflüsse bildet die Zelle vermehrt Proteine aus der Hitzeschockfamilie. Das sind sehr widerstandsfähige Proteine, die in Situationen zellulären Stresses andere Proteine stabilisieren können. Sie schaffen das im Zusammenspiel mit Chaperonen.
Gelingt die Stabilisierung oder Wiederherstellung der korrekten Faltung nicht, sind die Proteine erstmal unbrauchbar und müssen entsorgt werden. Was bei uns die Müllverbrennungsanlage oder der Recyclinghof übernimmt, erledigt im Körper das Proteasom. Zusammen mit einem kleinen Protein namens Ubiquitin (Ub) wird das kaputte Molekül mehrfach markiert, abgebaut und in die einzelnen Aminosäuren zerlegt.
Alle diese Systeme arbeiten koordiniert im Sinne einer Wiederherstellung oder Entsorgung von fehlgefalteten Proteinen. Dadurch vermag es der Körper, die Anhäufung von beschädigten Komponenten zu verhindern und die kontinuierliche Erneuerung intrazellulärer Proteine sicherzustellen. Ein weiterer Baustein unserer zellinternen Müllentsorgung ist die Autophagie, welche wir dir als 12. Hallmark of Aging näher vorstellen.
Soweit zur Theorie. In der Praxis gibt es leider keine Garantie dafür, dass diese ausgeklügelten Mechanismen zu jeder Zeit funktionieren. Das Stichwort Zeit bringt uns bereits zum nächsten Punkt.
Wusstest Du? Es gibt verschiedene Hitzeschock-Proteine in unserem Körper. Sie werden nach ihrem Gewicht eingeteilt. Wie ihr Name schon sagt, werden sie unter anderem durch Hitze aktiviert. Einer der besten Wege dafür sind Infrarotkabinen oder Saunagänge. Eine Steigerung der Konzentration an Hitzeschockproteinen geht mit einer Reihe an gesundheitsförderlichen Vorteilen einher.
In einer Studie konnten die Forscher zeigen, dass höhere Werte von Hsp70 den Enzündungsmediator Interleukin-10 senken konnte. Dadurch erklären sich die Forscher, warum Sauna bei Entzündungen wie der Arthritis helfen kann.
Falten – bei Proteinen top, im Alter Flop
Sind Falten in unserer Vorstellung ein Zeichen von Alter und damit eher negativ behaftet, so verhält es sich bei den Proteinen, wie wir mittlerweile wissen, genau andersrum.
Viele Studien haben gezeigt, dass sich die Proteostase mit steigendem Lebensalter verändert. Die chronische Ansammlung von fehlgefalteten oder ungefalteten Proteinen trägt zur Entwicklung einiger altersbedingten Krankheiten wie Morbus Alzheimer, Parkinson und Grauem Star bei. Die Häufigkeit dieser Pathologien nimmt ob der steigenden Lebenserwartung laufend zu.
Die Erzeugung von Chaperonen als Reaktion auf Stress ist im Alter zudem markant herabgesetzt. Studien an Tiermodellen unterstützen die Hypothese, dass der Chaperonabfall ursächlich für eine verminderte Lebensspanne ist. Gentechnisch veränderte Würmer und Fliegen beispielsweise, welche Chaperone verstärkt bilden, sind besonders langlebig. Auch bei langlebigen Mausstämmen fand man eine Hochregulation von einigen Hitzeschockproteinen.
Zusätzlich dazu zeigen Untersuchungen an Säugetierzellen, dass eine Hochregulation von SIRT1 die Hitzeschockreaktion verbessert. SIRT1 gehört zur Genfamilie der Sirtuine, die aufgrund der zahlreichen Wirkungen im Zusammenhang mit dem Altern als Langlebigkeitspfade bezeichnet werden. Viele weitere Experimente und Studien lieferten wissenschaftliche Evidenz für den Zusammenhang zwischen Chaperonmenge und Lebensspanne – diese alle zu nennen, sprengt den Rahmen dieses Artikels allerdings.
Proteostop
Die medizinisch-biologische Forschung hat also bereits eine Menge an Aufklärungsarbeit in Bezug auf die Proteostase geleistet, aber gibt es auch bereits handfeste Ansatzpunkte, um die altersbedingte Schwächung der Proteostase aufzuhalten? Tatsächlich gibt es dazu viele Studien.
Ein Ansatz zielt darauf ab, die durch Chaperone vermittelte Proteinstabilität und -faltung zu aktivieren. Im Mausmodell hat die medikamentöse Induktion eines speziellen Hitzeschockproteins die Muskelfunktion bewahrt und das Fortschreiten von gewissen Muskelkrankheiten verlangsamt. In anderen Modellorganismen setzten ForscherInnen ebenfalls Chaperone ein und verbesserten damit altersbedingte Phänotypen. Die Anstandsdamen unseres Körpers sind also nicht nur Gentlewomen, sondern auch Kämpferinnen an der vordersten Front gegen das Alter.
Ein anderer Ansatzpunkt sind das Proteasom und andere Mechanismen, die dem Abbau von kaputten Proteinen dienen, denn Studien zeigen, dass die Aktivität dieser Systeme mit zunehmendem Alter abnimmt. Das gelang mit ausgewählten Enzymen, die ihre Wirkung innerhalb dieses komplexen Signalwegs entfaltet haben.
Eine Nahrungsergänzung mit Spermidin aktivierte beispielsweise das Autophagie-System. Damit meint man den Abbau von beschädigten Zellstrukturen (wie Proteinen). Vereinfacht ähnelt die Autophagie in ihrer Funktion dem uns bekannten Proteasom.

Verlust der Proteostase – Ausblick
Es gibt also zahlreiche Hinweise darauf, dass Altern mit einer gestörten Proteostase vergesellschaftet ist und eine experimentelle Störung der Proteostase altersbedingte Veränderungen herbeiführen kann. Darüber hinaus gibt es verheißungsvolle Beispiele für Interventionen, die die Proteostase verbessern und das Altern bei Modellorganismen verzögern.
Bis auf den grauen Star, der mittels eines kleinen operativen Eingriffs kuriert werden kann, gibt es bis dato nur unzureichende Behandlungsmethoden für Pathologien wie Alzheimer und Parkinson. Beide Krankheiten sind sowohl für Betroffene als auch für dessen Angehörige sehr belastend und zeigen deshalb auch, wie wichtig es ist, die Forschungsanstrengungen im Bereich der Proteostase aufrecht zu erhalten. Vielleicht gelingt es in Zukunft den Horizont in der Proteostaseforschung von einer Krankheitsrelevanz in Richtung einer Gesundheitsrelevanz zu erweitern. Denn alles was verhindert werden kann, muss man später nicht behandeln.
Im nächsten Artikel dieser Reihe geht es um das fünfte Kennzeichen des Alterns: Deregulierte Nährstoffmessung.
Literatur
- López-Otín, Carlos et al. “Hallmarks of aging: An expanding universe.” Cell vol. 186,2 (2023): 243-278. Link
- Durairaj, Janani et al. “Uncovering new families and folds in the natural protein universe.” Nature vol. 622,7983 (2023): 646-653. Link
- Brunt, Vienna E, and Christopher T Minson. “Heat therapy: mechanistic underpinnings and applications to cardiovascular health.” Journal of applied physiology (Bethesda, Md. : 1985) vol. 130,6 (2021): 1684-1704. Link
- Pilch, Wanda et al. “The effects of a single and a series of Finnish sauna sessions on the immune response and HSP-70 levels in trained and untrained men.” International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group vol. 40,1 (2023): 2179672. Link
- Gressler, A Elisabeth et al. “Proteostasis in T cell aging.” Seminars in immunology vol. 70 (2023): 101838. Link
Grafiken
Die Bilder wurden unter der Lizenz von Canva erworben.