NAD ist die Kurzform von Nikotinamid Adenin Dinukleotid. Das Molekül besteht sinngemäß aus zwei Mononukleotiden, die über eine chemische Bindung miteinander verbunden sind. Es ist in fast all unseren Zellen vorhanden und niedrigere NAD-Spiegel sind ein Zeichen des Alterns.
Aus diesem Grund wird mit großem Eifer daran geforscht, wie man das Level im Alter möglichst hochhalten kann. In diesem Überblick erfährst du alles, was du über NAD wissen musst. Wir reisen dabei durch Vergangenheit, Gegenwart und Zukunft des Moleküls und stellen dir die wichtigsten Studien des Longevity-Moleküls vor.
Was ist NAD?
Es handelt sich bei NAD um ein Coenzym, welches man in fast jeder Zelle eines Organismus findet. Ein Coenzym ist ein kleines organisches Molekül, wie beispielsweise auch Vitamine, das mit einem Enzym zusammenarbeitet, um eine chemische Reaktion in Gang zu bringen. Stell dir als Analogie einen Co-Piloten vor. Dieser übernimmt wichtige Aufgaben, um den Piloten zu entlasten, so dass sie beide das Flugzeug sicher steuern können. Ähnlich verhält es sich mit NAD. Es wirkt unterstützend bei hunderten Prozessen in deinem Körper. Diese Teamleistung befähigt Moleküle wie NAD die Wirkung von Enzymen mitzubestimmen.
NAD wird einer Studie zufolge für über 500 dieser enzymatischen Reaktionen im Organismus benötigt. Da ist es erstmal naheliegend, dass der gefragte Co-Pilot eine wichtige Rolle in einer Reihe von biologischen Prozessen spielt. Welche biologischen Prozesse das genau sind, beantworten wir dir gleich. Bevor wir uns mit der Gegenwart beschäftigen, machen wir einen kurzen Abstecher in die Vergangenheit.
Rückblick
Das Molekül wurde erstmals 1906 von den beiden Wissenschaftlern Arthur Harden und William Young im Rahmen der alkoholischen Gärung beschrieben. Interessanterweise spielt NAD sowohl bei der Herstellung von Alkohol als auch beim Abbau davon eine Rolle. Drei Jahrzehnte später demonstrierte Otto Warburg erfolgreich, dass NAD eine Rolle bei Redox-Reaktionen im Körper spielt. Redox steht ausgeschrieben für Reduktion-Oxidation und beschreibt einen Typ chemischer Reaktionen, bei dem ein Reaktionspartner Elektronen (negative Ladungen) an einen anderen Reaktionspartner abgibt. Diese Art des chemischen Tauschhandels spielt bei Verbrennungs- und Stoffwechselvorgängen, bei Nachweisreaktionen von bestimmten Stoffen und in der technischen Produktion eine große Rolle. Margarine, Pyrotechnik oder Düngemittel auf Ammoniakbasis wurden beispielsweise erst durch die Redox-Reaktion Realität.
Wusstest Du? Niacin, eine Vorstufe von NAD, war das erste entdeckte „Medikament“, welches den LDL Spiegel senken konnte. In den 1950er Jahren gab Rudolf Altschul hohe Dosen an Niacin und senkte damit den Cholesterinspiegel. Die Entwicklung der heutigen Statine oder PCSK9-Hemmer setzte erst deutlich später ein.
In den 60er Jahren glaubte man dann bereits alles über NAD und seine Funktionen zu wissen, als eine neue Entdeckung Wellen schlug. Das Molekül spielt bei der PARylation, einem DNA-Reparaturprozess, eine Rolle. PARPs sind Enzyme, die NAD als Cofaktor benötigen. Diese Kenntnis verlieh der Forschung neuen Schwung.
Der Grund für die heutige Popularität des Moleküls in Wissenschaftskreisen ist das aber nicht, sondern eine sieben-köpfige Genfamilie namens Sirtuine (SIRT1-7). Sirtuine sind multifunktionale Enzyme, die beinahe alle Zellfunktionen regulieren können und NAD benötigen, um zu funktionieren. Die Wissenschaft verpasste den Sirtuinen ob des blühenden Optimismus rund um ihre Rolle in der rezenten Langlebigkeitsforschung kurzerhand die Bezeichnung Langlebigkeitsgene.
Wusstest Du? Fasten ist mittlerweile dafür bekannt günstige Effekte auf das Altern zu haben. Zu einem großen Teil treten diese Effekte durch die Aktivierung der Sirtuine, insbesondere SIRT1 auf. Es gibt sogar ganze Diäten, die auf die Aktivierung von Sirtuinen setzen. Die Sirtfood-Diät ist unter anderem durch die Sängerin Adele berühmt geworden. Auch der italienisch-amerikanische Arzt Valter Longo setzt mit seiner Scheinfasten Diät indirekt auf die Aktivierung von Sirtuinen.
Moleküle wie Glucosamin, Berberin und Spermidin können den Fastenprozess auf molekularer Ebene unterstützen.

NAD, NAD+ & NADH – who is who?
Diese drei Begriffe werden einmal nebeneinander und dann wiederum nur isoliert in wissenschaftlichen Abhandlungen verwendet. Am häufigsten ist die Bezeichnung NAD für NAD+ oder umgekehrt. Die Abgrenzung zu den jeweils anderen Molekülen fällt dabei oftmals etwas undurchsichtig aus. Das klingt nach Klärungsbedarf, dem wir jetzt nachkommen.
Zur Begriffsklärung trug die Entdeckung von Otto Warburg rund um NAD und seine Redox-Eigenschaften maßgeblich bei. Er war derjenige, der NAD als „chemisches Rückgrat unabhängig von der Ladung“ definierte. NAD+ ist demnach die oxidierte Form (kann Elektronen aufnehmen) und NADH die reduzierte Form (kann Elektronen abgeben) von NAD. In der Zusammenschau bezeichnet die Chemie NAD+/NADH als sogenanntes Redox-Paar.
Die Harmonie dieser Beziehung ist unglaublich wichtig für die Energiegewinnung im menschlichen Körper. NADH gibt im Mitochondrium, dem Kraftwerk der Zelle, Elektronen an die Atmungskette ab und ermöglicht dadurch die Herstellung des universellen Energieträgers von uns Menschen: Adenosintriphosphat (ATP). Übrig bleibt dann NAD+ und dessen Bereitschaft Elektronen wieder aufzunehmen.
NAD ist dann der allgemeine Begriff zur Beschreibung des Redoxpaares und seiner Reaktionen. Aus dem Grund verwenden wir bisher und auch im weiteren Verlauf die Bezeichnung NAD.
NAD-Stoffwechsel – drei Pfade zum Erfolg
Kleine Warnung vorab, wir müssen wieder einmal tiefer in die Physiologie und Biochemie unseres Körpers eintauchen. Aber keine Sorge, es wird sich lohnen, denn ein tieferes Verständnis für den NAD-Stoffwechsel wird dir helfen, eines der wohl spannendsten Moleküle in der Langlebigkeitsforschung besser zu verstehen.
Am Ende verstehst du, wann unser Körper das Molekül braucht, wie er es herstellt und wie es abgebaut wird. Zum Schluss dieses Kapitels zeigen wir auf, warum nach aktuellen wissenschaftlichen Erkenntnissen der NAD-Stoffwechsel komplexer ist, als angenommen und warum eine alleinige Supplementierung der Vorstufen wahrscheinlich nicht ausreicht.
Die NAD-Menge mag zwar über einen bestimmten Zeitraum hinweg konstant messbar sein, tatsächlich wird das Molekül in Zellen aber ständig neu zusammengesetzt, abgebaut oder recycelt. Im Durchschnitt belaufen sich die Vorkommen einer Person auf etwa drei Gramm.
Das Coenzym liegt im Körper in zwei „Zuständen“ vor – entweder als freies Molekül oder an Proteine gebunden. Das Verhältnis zueinander bezeichnet man als Ratio, die in Zellen und Geweben unterschiedlich ausgeprägt ist. Säugetierzellen können, abgesehen von Nervenzellen, NAD nicht importieren bzw. aufnehmen.
Folglich muss das Molekül aus unterschiedlichen Bestandteilen erst neu in der Zelle zusammengesetzt werden. Dieser de novo Pfad (‚de novo‘ lat. für „von neuem“) wird ausgehend von der essenziellen Aminosäure Tryptophan oder von anderen Formen von Vitamin-B3 beschritten.
Um den NAD-Spiegel zellintern zu erhalten, wird es hauptsächlich „recycelt“ über den sogenannten salvage pathway. „salvage“ kommt aus dem Englischen und bedeutet übersetzt so viel wie „bergen“ oder „retten“. Der Großteil von Nikotinamid Adenin Dinukleotid in unserem Körper wird also recycelt und nicht neu hergestellt. Es gibt dann auch noch einen dritten Pfad das Molekül zu erzeugen. Im „Preiss-Handler pathway“ bildet Niacin den Ausgangsstoff. Niacin und Tryptophan sind im NAD Regenerating Complex (regeNAD) enthalten.
In der folgenden Grafik sind die erwähnten Stoffwechselwege nochmals übersichtlich dargestellt.
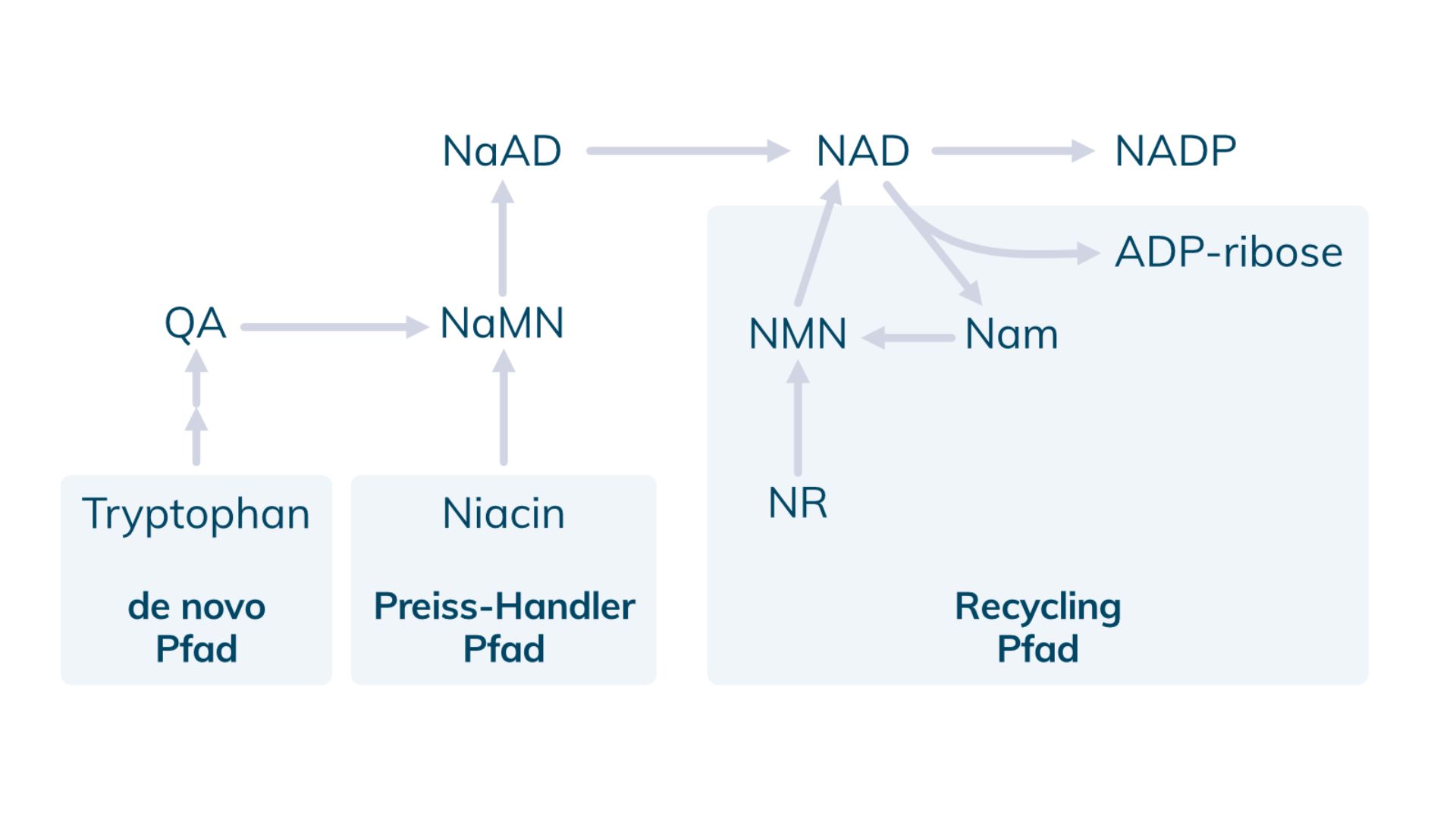
NAMPT – der Schlüssel zur Gewinnung von NAD
In der Herstellung von NAD gibt es einen geschwindigkeitsbestimmenden Schritt. Das bedeutet, dass die Synthese in Abhängigkeit von einem Enzym abläuft. Ist genug von dem Enzym da kann sehr viel vom Molekül produziert werden – fehlt das Enzym, dann sistiert die Produktion, oder wird zumindest eingeschränkt.
Das Schlüsselenzym trägt den Namen NAMPT und unterstützt den ersten Schritt im Recyclingpfad, wo Nikotinamid (Nam) in Nikotinamid Mononukleotid (NMN) umgewandelt wird. Die NAMPT-Menge ist hochdynamisch – kann sich also sehr rasch an den sich ändernden NAD-Bedarf in der Zelle anpassen. Zu diesen ändernden Bedingungen zählt auch Zellstress, der durch DNA-Schäden oder Hunger ausgelöst wird.
Abbau von NAD
Unser Körper kann NAD über verschiedene Wege abbauen. Einer der wichtigsten ist dabei das Enzym CD38. Das „CD“ steht allerdings nicht für compact disc und die darauffolgende Zahl ist nicht das Volume der BRAVO-Hits – CD ist in diesem Fall die Abkürzung für „cluster of differentiation“.
Diese „Cluster“ sind Oberflächenmerkmale auf Zellen. Stell dir das Ganze als eine Art Erkennungsmerkmal von Zellen vor. Über diese Oberflächenmoleküle können beispielsweise patrouillierende Immunzellen erkennen, ob es sich um Eindringlinge mit „falschen“ Oberflächenmerkmalen handelt. Neben der reinen Erkennungsfunktion sind diese Moleküle auch gleichzeitig häufig Enzyme. Das bedeutet, sie sind für biochemische Reaktionen in unserem Körper verantwortlich. Bis heute sind etwa 400 dieser Merkmale bekannt.
Wusstest Du? Die Entdeckung einer verstärkten Ausprägung von manchen dieser Unterscheidungsmerkmalen auf Krebszellen hat beispielsweise zu bahnbrechenden Fortschritten in der Krebstherapie geführt. Forscher haben Antikörper entwickelt, die gegen gewisse CD gerichtet sind. Ein Beispiel dafür ist CD20 im Rahmen von Lymphomen. Der Antikörper bindet an das CD-Molekül und markiert die Zelle so für das Immunsystem, welches die Tumorzelle (und leider auch alle gesunden Zellen mit dem gleichen Oberflächenmerkmal) angreifen kann.
CD38
CD38 kommt nicht nur auf manchen, sondern gar auf allen Zellen vor und sorgt durch seine enzymatische Funktion für den Abbau von NAD+. Herausgefunden hat man dies, indem man Mäuse genetisch verändert hat, so dass sie kein CD38 mehr besitzen. Diese Versuchstiere hatten deutlich höhere NAD-Spiegel.
Ein weiteres Molekül, welches sich in der Forschung als wirksamer CD-38 Hemmer herausgestellt hat, ist das Apigenin, welches man in der Natur zum Beispiel in Petersilie findet. Mit Apigenin behandelte Mäuse hatten in etwa 50% mehr NAD als die Kontrollgruppe.
Es gibt auch noch einen dritten wissenschaftlichen Fingerzeig in diese Richtung: In einer Untersuchung wurde bei alten, 32 Monate alten Mäusen, CD38 genetisch „abgeschaltet“. Dadurch stiegen die NAD-Level bei den alten Mäusen wieder so stark an, dass sie das gleiche Niveau wie ihre jüngeren Artgenossen hatten. Zusätzlich waren diese Mäuse resistent gegen die negativen Effekte von fettreicher Ernährung wie Fettleber oder Glukoseintoleranz.
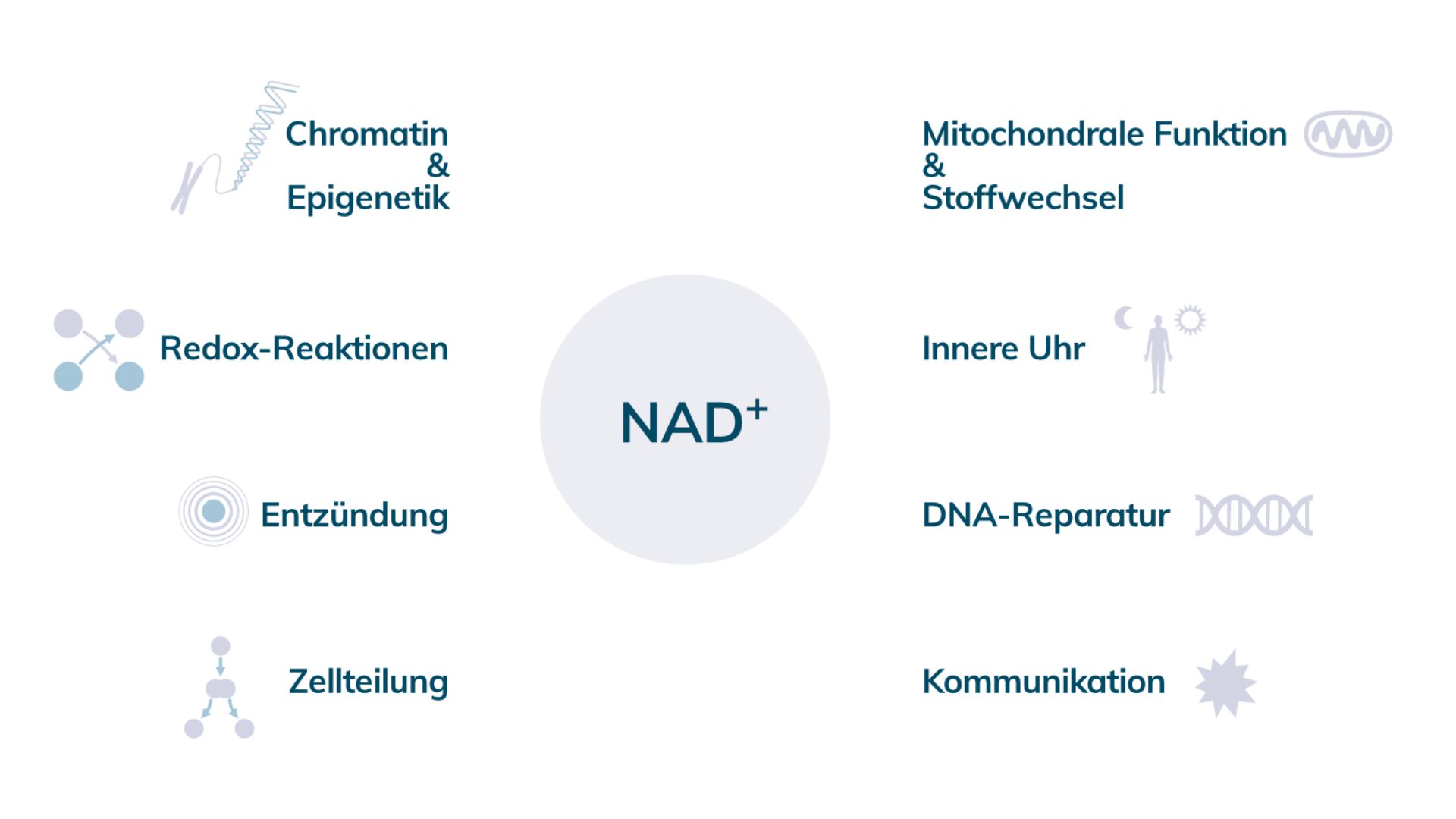
Was macht NAD im Körper?
NAD-abhängige Prozesse finden sich zu hunderten in unserem Körper. Zwei der wichtigsten Signalproteinfamilien für die Langlebigkeitsforschung sind die Sirtuine und die PARPs. Sirtuine, auch als Langlebigkeitsgene bezeichnet, wurden Mitte der 80er Jahre als Telomer-schützende Proteine beschrieben. Heute wissen wir, dass sie noch weitaus mehr können. Sie spielen im Mitochondrien-Stoffwechsel, bei Entzündungen, der Zellteilung, bei Autophagieprozessen, dem zirkadianen Rhythmus und beim geplanten Zelltod (Apoptose) eine wichtige Rolle.
Während die Sirtuine-Familie „nur“ sieben Vertreter aufweist, ist die PARP-Familie deutlich größer. Jedoch sind noch nicht alle Unterklassen gleich gut erforscht. Diese Grundlagenforschung ist sehr komplex und umfangreich, weshalb auf Forscherinnen und Forscher noch viel Arbeit wartet, um das Verständnis davon entsprechend zu verbessern.
Wir wissen mittlerweile, dass PARP1 und PARP2 eine wichtige Rolle in der Reparatur der DNA und in der Translation spielen. Unter Translation verstehen die Wissenschaftler den Prozess, bei dem unser genetischer Code in ein wirkungsvolles „Protein“ übersetzt wird.
Welche Rolle spielt nun NAD in diesem Prozess? Ist unsere DNA geschädigt, kommt es zu einer Überaktivierung von PARP1, was wiederum den NAD Spiegel in unseren Zellen zum sinken bringt. Dies ist einer der Gründe, warum Zellen dann später „geplant“ zugrunde gehen.
Aber wieso macht unser Körper das? Tatsächlich ist der Mechanismus ziemlich clever. Beschädigte DNA kann zu Fehlfunktionen und Erkrankungen führen. Unser Körper will solche fehlerhaften Zellen so schnell es geht loswerden. Der PARP1/NAD Weg ist einer davon. Bei gesunden Zellen verhält sich PARP1 übrigens ganz anders. Es wird zu einem sogenannten low-turnover-Enzym. Das bedeutet, nur sehr wenig NAD wird durch PARP1 abgebaut. Erst bei DNA-Schäden (die im Alter häufiger werden) wird PARP1 aktiv.
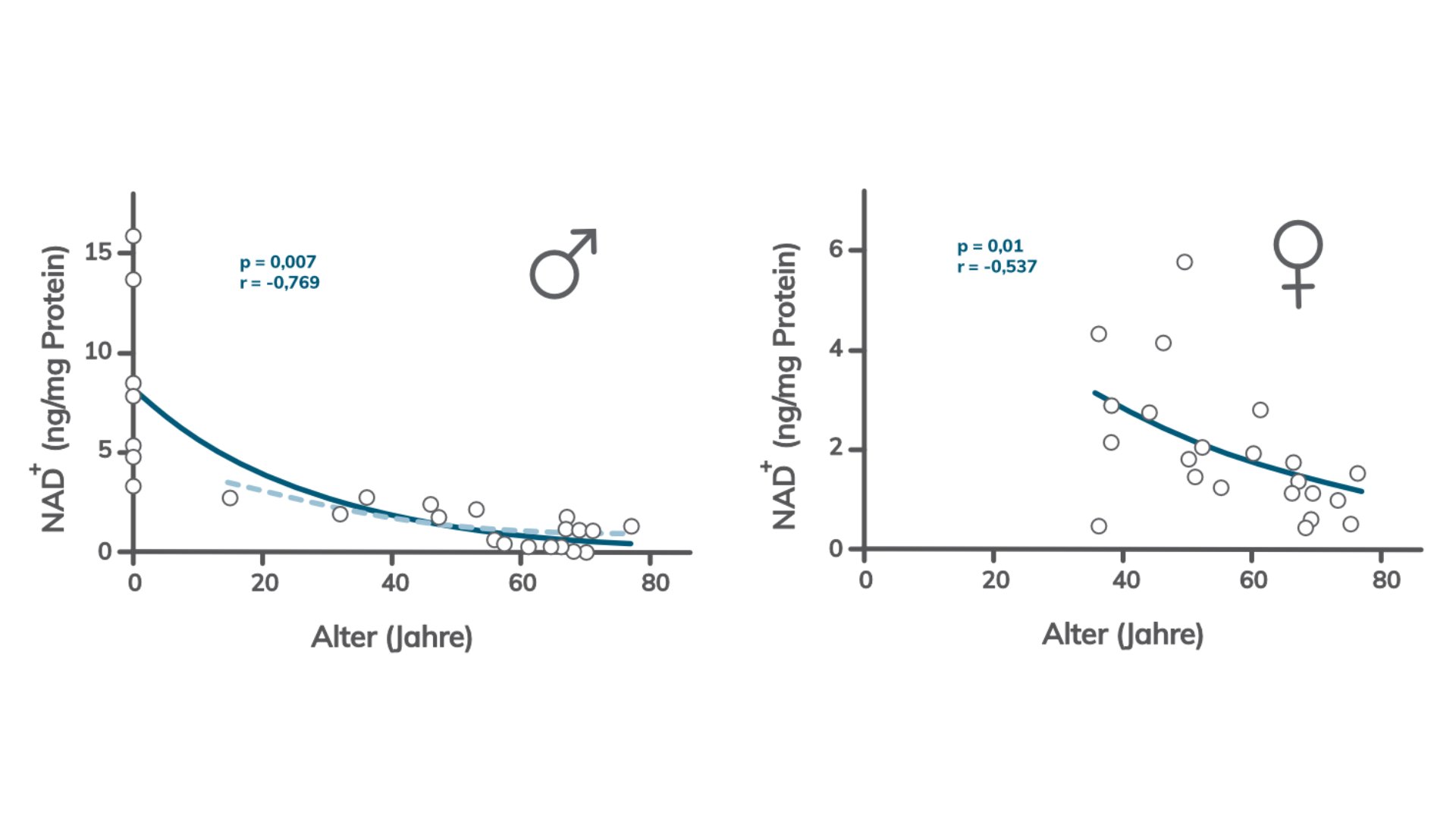
Warum nimmt NAD im Alter ab?
Für diese zentrale Frage der Alternsforschung haben Wissenschaftler drei mögliche Erklärungen:
- Die NAD-Produktion nimmt im Alter ab
- Der Abbau wird gesteigert (z.B. durch CD38)
- Eine Kombination aus beiden Vorgängen
Um das genauer einordnen zu können, hilft ein neuerlicher Blick in die NAD-Forschung. Damit du dich nicht durch seitenlange, trockene Studien quälen musst, haben wir dir die wichtigsten Punkte einmal aus den verschiedenen Arbeiten zusammengefasst:
Abnahme der NAMPT-Aktivität
Kurzer Refresher, NAMPT ist das geschwindigkeitsbestimmende Enzym im Recycling-Pfad – dem aktivsten NAD+-Stoffwechselweg im Organismus. Vielleicht eine Analogie hierzu. In der Formel 1 benötigen etwa zehn Mechaniker gut 2 Sekunden um 4 Reifen eines Autos zu wechseln.
Wenn du die Reifen allein wechselst, brauchst du deutlich länger. In dem Fall ist die Anzahl der Mechaniker der geschwindigkeitsbestimmende Schritt – je weniger Menschen daran beteiligt sind, desto länger wird es dauern. So kannst du dir das bei NAMPT vorstellen. Im Alter ist einfach weniger vom Enzym vorhanden und dadurch wird deine NAD-Synthese langsamer.
Überaktivierung der PARPs
Je älter wir werden, desto mehr DNA-Schäden häufen sich an. Unser Körper wird nicht mehr so effektiv darin kaputte Zellen zu eliminieren und Zellstress und Inflammaging nehmen zu. Durch die vielen DNA-Schäden kommt es zu einer Überaktivierung von PARP1 und damit zu einem erhöhten NAD-Verbrauch. Die Forschungsergebnisse zu PARP1-Hemmung sind allerdings noch sehr vage. Hier können wir dir nicht genau sagen, ob es überhaupt von Vorteil ist PARP1 zu hemmen.
CD38 – ein möglicher „Übeltäter?“
Neben den PARPs nimmt im Alter auch die Aktivität von CD38 zu. Warum ist das der Fall?
Mittlerweile ist klar, dass die CD38-Aktivität sehr komplex reguliert wird. Der scheinbar wichtigste Zusammenhang besteht zwischen CD38 und chronischen Entzündungsprozessen. Diese stille „Inflammation“ wurde in zahlreichen Studien mit Krankheitsprozessen im Alter in Verbindung gebracht (Inflammaging). Durch die dauerhafte Entzündung wird CD38 hochreguliert, was wiederum ordentlich (und dauerhaft) NAD verbraucht.
Weniger NAD bedeutet dann schlussendlich eine weniger effiziente Energiebereitstellung und eine verminderte Funktionalität von abhängigen Enzymen (siehe Sirtuine und PARPs).
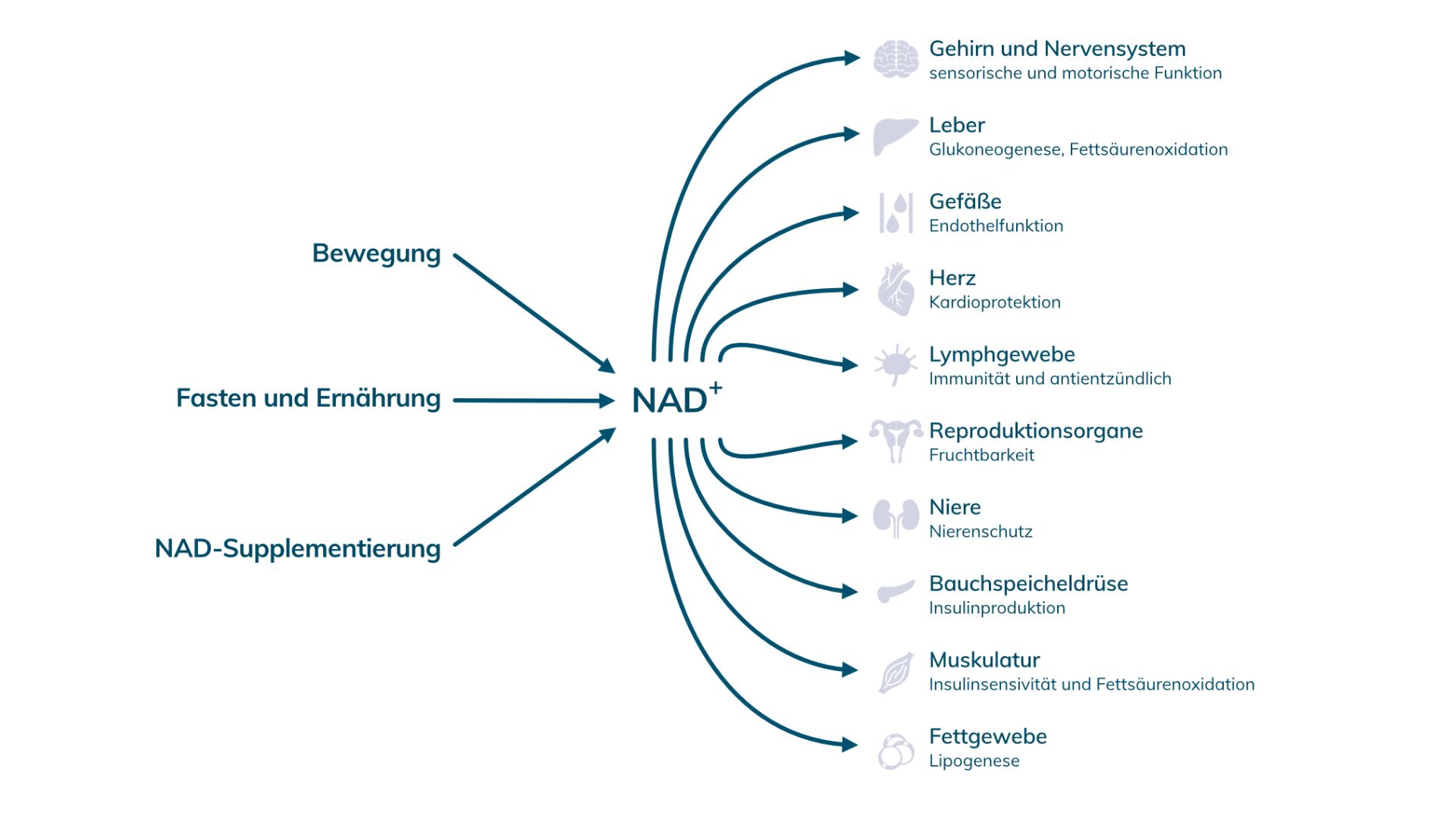
Kann man die Abnahme aufhalten?
Genauso wie es unterschiedliche Hypothesen für die altersbedingte Abnahme gibt, gibt es auch verschiedene Ansätze den NAD-Spiegel zu erhalten.
(1) Supplementierung von Vorstufen
Fakt ist, dass im Alter mehr NAD verbraucht wird. Ein logischer Gedanke wäre deshalb, die Produktion zu steigern bzw. das Recycling zu unterstützen. Die Einnahme von NAD-Vorläufern zu diesem Zweck ist auch tatsächlich ein gut untersuchter wissenschaftlicher Ansatz, um den Spiegel hochzuhalten.
Würden wir NAD direkt zu uns nehmen, würde das wenig bringen, da einerseits das Molekül in unserem Magen „zersetzt“ wird und es andererseits keinen Transporter für NAD in der Zellmembran gibt. Deswegen werden die, üblicherweise sehr teuren, NAD-Infusionen durchaus kritisch diskutiert. Hier wird das Problem mit der Magensäure zwar umgangen – das Molekül ist aber trotzdem „zu groß“ um direkt in die Zellen zu gelangen.
Bei NAD-Vorläufern handelt es sich in der Regel um verschiedene Vitamin B3-Varianten wie Nicotinamid, Niacin oder Tryptophan. Auch das bekannte Nicotinamid Ribosid (NR) zählt dazu. In 10 Studien an Menschen mit dem Vorläufermolekül NR fanden die Forscher allerdings widersprüchliche Ergebnisse. Bei einigen führte es zu einer starken NAD-Erhöhung und auch zu den erhofften Gesundheitsvorteilen, in anderen Studien allerdings nicht.
Ein Erklärungsansatz dafür ist, dass NR nicht die „optimale“ Vorstufe ist. Forscher fanden nämlich heraus, dass sich zwar andere Abbauprodukte von NAD, wie das MeNAM und das Me2YP nach einer Supplementierung mit NR erhöhten, nicht immer jedoch NAD. Das deutet darauf hin, dass neues NAD auf Basis einer NR-Supplementation einfach schneller abgebaut wurde.
(2) Aktivierung von Enzymen, die NAD herstellen
Eine weitere Stellschraube im NAD-Stoffwechsel sind die erforderlichen Enzyme für die Erzeugung des Moleküls – darunter NAMPT und NMNAT. Ersteres katalysiert die wichtige, geschwindigkeitsbestimmende Reaktion von Nikotinamid(Nam) in Nikotinamid Mononukleotid (NMN). Ohne dieses Enzym, kann unser Körper kein NAD herstellen. Interessanterweise konnte Sport in einer Studie zu einem 127-prozentigen Anstieg von NAMPT führen.
Das zweite wichtige Enzym ist NMNAT. Es ermöglicht den allerletzten Schritt in der Herstellung von NAD – nämlich die Übertragung von ATP auf NMN. In diesem Zusammenhang ist Epigallocatechingallat (EGCG) – der wichtigste Inhaltsstoff des grünen Tees – ein vielversprechender Booster von NMNAT.
Abgesehen von speziellen Molekülen konnte auch Fasten, bzw. kalorische Restriktion in einigen Studien die NAD-Level erhöhen. Der physiologische Hintergrund ist komplex, da eine Reihe von Stoffwechselvorgängen daran beteiligt sind. Zum einen kommt es beim Fasten zu einer Aktivierung von Sirtuinen und AMPK – zum anderen zu einer Abnahme der mTOR Aktivität. Unsere Zellen schalten dadurch evolutionsbedingt in eine Art Resilienzmodus um. Kleiner Nebeneffekt: Fasten senkt auch die Entzündungswerte im Körper.
(3) Hemmung des Abbaus
Wir haben bereits gesehen, welche große Rolle CD38 und PARP1 im NAD-Abbau spielen. Insbesondere die Hemmung von CD38 scheint in Tierstudien ein vielversprechender Weg zur NAD-Erhöhung zu sein. Ein Moleküle, das einen potenten CD38 Hemmer darstellt, ist Apigenin . Beide können den zellulären NAD+-Spiegel erhöhen und haben in einer Studie auch positive Stoffwechseleffekte gezeigt.
Welche Vorteile hat ein hoher NAD-Spiegel?
Dass der NAD-Spiegel mit zunehmendem Alter fällt, ist wissenschaftlich bewiesen. Ebenso ist bekannt, dass das zahlreiche negativen Konsequenzen hat. Was sind nun aber konkrete Vorteile von einem höheren intrazellulären Spiegel?
Wie misst man eigentlich NAD? Mit sehr hoher Wahrscheinlichkeit wird dir dein Hausarzt keinen Test dafür anbieten können – die Auswertung ist nämlich nur in speziellen Laboren möglich. Dabei ist die Bestimmung durchaus wichtig – etwa wenn deinen NAD-Spiegel beeinflussen möchtest.
Zusammen mit der Universität Vilnius hat MoleQlar den bis dato einzigen europäischen NAD-Test entwickelt. So kannst du herausfinden wo du stehst und überprüfen, welche Methode dir nachweislich hilft deine Level zu erhöhen.

NAD und Gedächtnisleistung – mehr Power für deine Nervenzellen
Milliarden von Nervenzellen, die sowohl am Tag als auch in der Nacht aktiv sind, bilden unser Gehirn. Es ist wohl eine der faszinierendsten Einrichtungen unseres Körpers. Fast 120g Zucker, in Form von Glukose und etwa 20% des täglichen Sauerstoffbedarfs gehen auf die Rechnung dieses etwa 1,5kg schweren Organs.
Der hohe Energiebedarf setzt natürlich eine entsprechend hohe Mitochondrien-Dichte voraus. NAD als wichtiger Mitochondrien-Agent hat deshalb hier seine Finger im Spiel. Studien ergaben, dass Menschen Alzheimer durch eine NAD-Spiegel Erhöhung eine verbesserte Mitochondrien-Funktion hatten und sich ihre Gedächtnisleistung dadurch verbesserte.
Auch unser restliches Nervensystem profitiert vom Molekül. Durch ein erhöhtes Level verbesserte sich die Reizübertragung signifikant. Zudem zeigt eine Studie, dass lautstärkebedingter Hörverlust reduziert wird. Und wer schon einmal nach einem Konzert für einige Stunden alles gedämpft gehört hat, weiß wie unangenehm das sein kann.
Wusstest Du? Neben Funktionseinbußen werden unsere Mitochondrien im Alter auch zahlenmäßig weniger. Ein Weg mehr Mitochondrien zu produzieren, ist Sport. Egal ob Kraft oder Ausdauer – beides fördert die Produktion neuer Zellkraftwerke.
Zusätzlich konnte in einer Studie des Bayor College of Medicine gezeigt werden, dass die regelmäßige Einnahme von GlyNAC zu einer messbaren Verbesserung der Mitochondrien Funktion führte.
Verbesserte Muskelfunktion
Nicht nur unser Gehirn ist auf Mitochondrien angewiesen, sondern auch unsere Muskelzellen. Wir benötigen das ATP, um unsere Muskelfasern zu kontrahieren. Je mehr ATP wird durch unsere Mitochondrien generieren können, desto kräftiger oder desto ausdauernder sind wir.
In Tierstudien konnte immer und immer wieder gezeigt werden, dass höhere NAD-Level zu einer verbesserten Muskelfunktion beitragen können. Liegt hier also ein mögliches Geheimnis, wie wir unseren Körper darin unterstützen können auch im Alter noch fit und agil zu sein?

Effekte auf das Herz-Kreislaufsystem
Wenn es um Energie geht, dann ist auch das Herz nicht wegzudenken. Kein anderer Muskel ist so ausdauernd, wie unser Herz. Mehr als 1 Milliarde mal wird es im Verlauf unseres Lebens schlagen, ohne dass sich neue Zellen bilden. Dafür benötigt es eine unfassbare Menge an Mitochondrien.
Mehr als 30% der Zellmasse wird von unseren Zellkraftwerken eingenommen und diese benötigen alle NAD. Und genau deshalb profitiert unser zentrales Vitalorgan von einem erhöhten NAD-Angebot. Das Ergebnis: leistungsstärkere Herzzellen und eine gesteigerte Pumpkraft.
Wusstest Du? Einer der wichtigsten Faktoren für die Herz-Kreislauf Gesundheit, sind deine Blutfettwerte. Die seit vielen Jahrzehnten bestehende Annahme vom „guten“ und „schlechten“ Cholesterin, hat sich nach neueren Studien als unzutreffend herausgestellt. Vielmehr muss man die einzelnen Blutfettwerte nebeneinander betrachten.
Wenn du mehr über die einzelnen Blutfettwerte und den Eier-Mythos erfahren willst, dann lies dir unseren großen Blutfettwerte Guide im Magazin durch.
Entgiftungsbooster
Neben Muskel- und Nervenzellen gibt es eine dritte Zellart, die nachweislich von hohen NAD Spiegeln profitiert: Leberzellen
Unsere Leber muss tagtäglich eine ganze Fülle an Aufgaben erledigen. Sie speichert Energie in Form von Glukagon, stellt wichtige Proteine für unser Gerinnungssystem her und ganz wichtig: sie entgiftet unseren Körper. Dafür stehen der Leber eine Vielzahl an verschiedenen Enzymen bereit, die du dir wie Werkzeuge vorstellen kannst. Diese Werkzeuge funktionieren allerdings nur gut, wenn ausreichend NAD zur Verfügung steht.
NAD als Infektionsschutz?
Eine Studie hat sich mit der Immunabwehr bei SARS-CoV-2 Infektionen beschäftigt und dabei interessante Ergebnisse gefunden: NAD kommt über das PARP-Enzym eine wichtige Rolle in der Virenabwehr zu.
Aber hieß es nicht, dass PARP1 zu einem Abbau von NAD führt? Das stimmt, allerdings gibt es neben PARP1 verschiedene Unterklassen der PARP-Familie. Einige davon sind in der zellulären Immunabwehr gegen Viren eingebunden. Diese PARP-Moleküle (nicht PARP1) benötigen wiederum NAD, um besser zu funktionieren. Zwar konnte diese Studie „nur“ einen direkten Zusammenhang mit SARS-CoV-2 finden, es ist aber möglich, dass dies auch auf andere virale Erreger übertragbar ist.

NAD – der Jungbrunnen des Lebens?
Neben all den leistungssteigernden Effekte auf die Organe, stellt sich die Frage, warum sich hohe NAD-Spiegel in so vielen Studien positiv auf Gesundheit und Langlebigkeit ausgewirkt haben? Eine Erklärung hier ist, dass sich NAD auf alle molekularen Kennzeichen des Alterns auszuwirken scheint. Konsequenterweise führt eine Erhöhung des NAD-Spiegels zu einer Verbesserung aller Hallmarks.
Dies macht dieses Molekül so interessant in der Langlebigkeitsforschung. Während viele Stoffe nur einen Teil des Problems angehen, scheint man mit NAD einen aussichtsreichen Kandidaten gefunden zu haben, der möglichst viele Alterungsprozesse gleichzeitig angeht.
Wir haben gesehen, dass der NAD-Stoffwechsel komplex ist und von vielen Faktoren abhängt. Auch der Abbau von NAD spielt eine größere Rolle als anfangs gedacht. Hier gibt es noch einige Fragen zu klären. Beispielsweise wissen wir, dass bei älteren Menschen ein höherer CD38 Spiegel für den Abbau verantwortlich ist. Hohe CD38 Spiegel sind mit erhöhten Entzündungswerten und DNA-Schäden assoziiert. Doch was kommt zuerst? Ähnlich wie beim Henne-Ei-Problem, wissen wir noch nicht genau, wie sich die einzelnen Faktoren untereinander beeinflussen.
Bis diese komplexen Fragen geklärt sind, wird es wohl noch etwas dauern – das NAD-Thema bleibt jedenfalls spannend! Was mittlerweile wissenschaftlich sehr gut abgesichert ist, ist die Tatsache, dass hohe NAD-Spiegeln für unseren Körper von Vorteil sind. Aus diesem Grund kann es für jeden sinnvoll sein, seinen eigenen NAD-Spiegel zu bestimmen und durch die Kombination aus Bewegung, einer gesunden Ernährung und entsprechenden Boostern dem natürlichen Abfall entgegenzuwirken!
Literatur
- Rajman, L., Chwalek, K., & Sinclair, D. A. (2018). Therapeutic potential of NAD-boosting molecules: the in vivo evidence. Cell metabolism, 27(3), 529-547.
https://doi.org/10.1016/j.cmet.2018.02.011 - Harden, A., & Young, W. J. (1906). The alcoholic ferment of yeast-juice. Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character, 77(519), 405-420.
https://doi.org/10.1098/rspb.1906.0029 - Warburg, O., & Christian, W. (1936). Pyridin, der wasserstoffübertragende Bestandteil von Gärungsfermenten. Helvetica Chimica Acta, 19(1), E79-E88.
https://doi.org/10.1002/hlca.193601901199 - Chini, C. C., Tarragó, M. G., & Chini, E. N. (2017). NAD and the aging process: Role in life, death and everything in between. Molecular and cellular endocrinology, 455, 62-74.
https://doi.org/10.1016/j.mce.2016.11.003 - Sultani, G., Samsudeen, A. F., Osborne, B., & Turner, N. (2017). NAD+: A key metabolic regulator with great therapeutic potential. Journal of Neuroendocrinology, 29(10), e12508. https://doi.org/10.1111/jne.12508
- Anderson, K. A., Madsen, A. S., Olsen, C. A., & Hirschey, M. D. (2017). Metabolic control by sirtuins and other enzymes that sense NAD+, NADH, or their ratio. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1858(12), 991-998. https://doi.org/10.1016/j.bbabio.2017.09.005
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8649045/
- https://www.sciencedirect.com/science/article/pii/S0006295222000405?via%3Dihub
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9861325/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9935856/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9735188/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4112140/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8869961/
- https://www.science.org/doi/10.1126/science.abe9985
- https://www.spektrum.de/lexikon/neurowissenschaft/gehirnstoffwechsel/4122
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5830901/
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4340807/
Grafiken
Die Bilder wurden unter der Lizenz von Canva erworben.